Olá pessoal! Seguindo os posts dedicados aos esmaltes, esta semana eu vou escrever sobre as características físico-química dos esmaltes e explicar como calcular a fórmula de unidade molecular de Seger.
A Natureza dos Vidros
Estudamos que o esmalte é composto principalmente pelo formador de vidro. Ele é que dá a característica impermeável e lisa que encontramos na superfície cerâmica. Os vidros são elementos únicos que não são nem líquidos ou sólidos. São elementos conhecidos por estarem em um estado chamado amorfo.
Sólidos são estruturas altamente organizadas. Neles estão os cristais, como o sal, com seu milhões de átomos alinhados. Sua estrutura é previsível. Os vidros não possuem essa organização mas também não são tão desorganizados quanto um líquido.
Abaixo podemos comparar a disposição molecular do óxido de silício em seu estado cristalino (esquerda) e seu estado vítreo (direita).

Observamos que o vidro possui uma certa organização mas ela não se repete ao longo da cadeia. Quando o vidro é formado, o elemento formador de vidro (normalmente a sílica) é resfriada rapidamente de seu estado líquido mas não se solidifica quando fica à temperaturas abaixo de seu ponto de fusão. Neste ponto, o material é um líquido super-resfriado, um estado intermediário entre líquido e vidro. Para se transformar em um sólido amorfo, o material é resfriado mais ainda, abaixo da temperatura de transição do vidro. Após esse ponto, os átomos deste elemento estão quase imóveis, impossibilitados de se organizarem em estruturas cristalinas e o material agora é um vidro.
Como o vidro se encontra em um estado de desorganização molecular, seus átomos ainda podem fluir como líquidos mas modelos matemáticos prevêem que seria necessário um tempo superior ao tempo do universo para que houvesse uma mudança substancial na forma do vidro por conta dessa fluidez molecular.
Fundentes
Nos esmaltes comuns, os óxidos fundentes estão em menor porcentagem se comparados com o formador de vidro sílica e o estabilizador Al2O3. Em altas temperaturas (1.300º C), o esmalte contém por volta de 18% de fundentes. À meia queima (1.180º C), 22%. E em baixa queima pode ter até 30% de fundente (incluindo o elemento formador de vidro boro).
Além disso, cada fundente possui um determinado ponto de fusão e volatilização, sendo mais adequados para as queimas em determinadas temperaturas. Veja tabela abaixo:

Mas, como o fundente age para baixar a temperatura de fusão do esmalte? Isso é o que vamos ver a seguir.
Misturas Eutéticas
O fundente juntamente com o formador de vidro formam o que chamamos de mistura eutética. Uma mistura é eutética quando o ponto de fusão do conjunto é inferior às temperaturas de fusão de cada componente da mistura.

Sabemos pelo post anterior que a maioria dos fundentes são metais alcalinos e alcalinos terrosos. Eles têm a tendência de doarem elétrons para se tornarem mais estáveis. Normalmente, eles doam elétrons para um elemento ávido por eles, o oxigênio, que se encontra do outro lado da tabela periódica. Quando dissolvidos em sílica, que é um ácido fraco, os elementos alcalinos então transformam-se em cátions (átomos com carga positiva) e o oxigênio em ânion (carga negativa). O ânion duplamente negativo do oxigênio tem uma grande afinidade por ligações e quebra a ligação de oxigênio da molécula de sílica, se incorporando à ela com carga negativa. Essa quebra de cadeia faz com que as cadeias fiquem menores, mais fluidas, baixando o ponto de fusão. Tomando como exemplo o óxido de cálcio como fundente, temos:

Além disso, os elementos fundentes se inserem nas cadeias de moléculas de sílica, oferecendo um flexibilidade maior à mistura. Ou então ficam entre as cadeias de sílica como impurezas, dificultando a cristalização do vidro.
Estabilizador
Para conter uma fluidez excessiva, fazemos o esmalte mais viscoso. O óxido de alumínio combina com cadeias soltas de sílica criando uma rede coesa de moléculas, sendo um importante elemento estabilizador do esmalte.

Fórmula de Unidade Molecular de Seger
Agora que entendemos melhor sobre como o esmalte funciona quimicamente, vou introduzir o conceito levantando pelo alemão Herman A. Seger no final do séc. XIX. Seger também desenvolveu cones numerados para medir o trabalho do calor dentro dos fornos, entre outras coisas. Foi ele quem classificou os componentes dos esmaltes em fundentes, formadores de vidro e estabilizadores. Sua fórmula de unidade molecular mostra a relação entre o número de moléculas entre as três categorias, facilitando a análise do esmalte.
Com esta fórmula, podemos saber se o esmalte tem sílica suficiente para a formação do vidro, por exemplo, ou se existem fundentes demais. No próximo post, vou escrever sobre quais são os limites que fazem um bom esmalte utilitário mas é necessário o entendimento desse cálculo primeiramente.
Hoje em dia existem programas para o computador que já calculam a fórmula de Seger automaticamente, sendo necessário somente a entrada das matérias-primas e a quantidade delas, o que torna o processo muito mais prático. Para quem quiser entender porém como é a base do cálculo, vamos fazer um exemplo:
Supomos que vamos trabalhar com a seguinte fórmula de esmalte:
| Matéria-prima | Quantidade |
| Nefelina Sienito | 40 |
| Carbonato de Cálcio | 20 |
| Sílica (Quartzo) | 30 |
| Caulim | 10 |
| Total | 100 |
Primeiro passo é pegar o massa molecular para os principais óxidos (na wikipedia tem esses dados).
| Si02 | Al2O3 | Na2O | K2O | MgO | CaO | Fe2O3 | TiO2 |
| 60,09 | 101,96 | 61,98 | 94,20 | 40,31 | 56,08 | 159,70 | 80,90 |
Agora, temos que pegar a composição química de cada matéria-prima. O site glazy.org dispõe dessas informações gratuitamente.
Para facilitar o cálculo, montei uma tabela com as matérias-primas e a proporção de óxidos para cada uma:
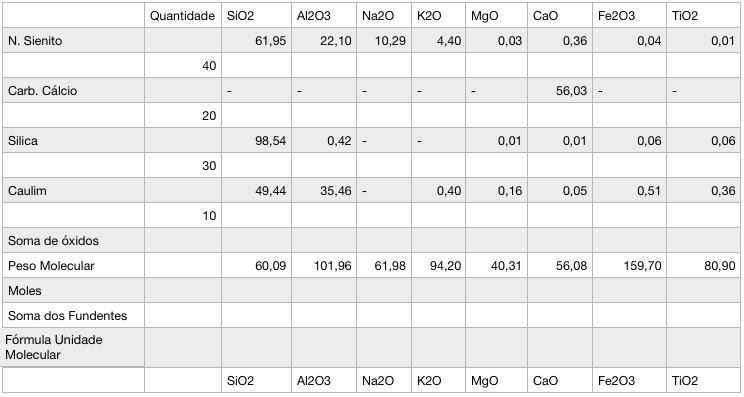
1º passo: Calcular a proporção de cada óxido por quantidade de matéria-prima. No exemplo, temos que o elemento Nefelina Sienito tem 40 de 100 (total), ou seja, 0,4 do total. Multiplica-se 0,4 x a quantidade do óxido. Para o caso da sílica, o cálculo é 0,4 x 61,95= 24,78.
Fazemos isso com todos as matérias-primas e a tabela ficará assim:
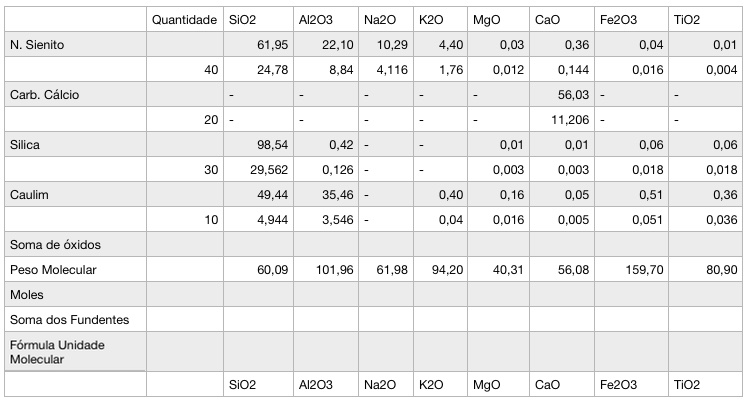
2º passo: Some os mesmos óxidos de todas as matérias-primas.

3º passo: dividir a soma dos óxidos pelo peso molecular de cada óxido. Isso vai dar a proporção em relação ao número de moléculas de um dado óxido. Para a química, o que importa nas reações é o número de elementos (cabem mais átomos de lítio em 10g que átomos de chumbo, por exemplo).

4º passo: somamos os moles dos fundentes (Na, K, Mg e Ca).

5º passo: dividir os moles de cada óxido pela soma dos moles dos fundentes.
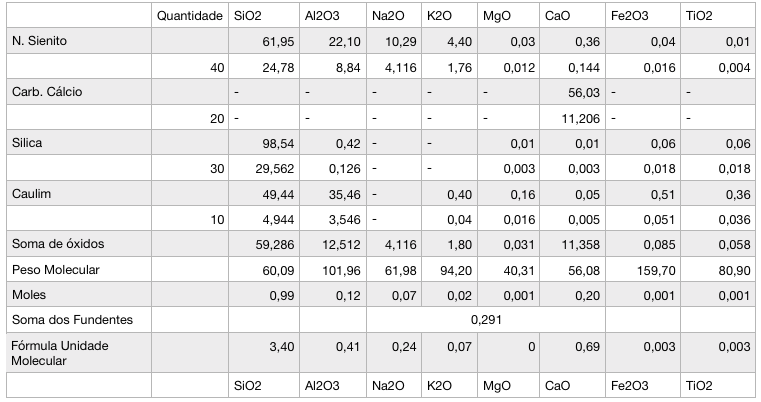
Temos o resultado final, representado pela última linha de cálculo. O que fizemos foi pegar cada óxido por representação de quantidade molecular e colocar cada um deles em relação aos fundentes. Assim, criou-se um padrão sendo a soma dos fundentes sua unidade. Com isso, podemos analizar os esmaltes de maneira muito mais completa, só olhando sua fórmula de Seger!
No próximo post, vocês vão saber como usar esse conhecimento para predizer o comportamento dos esmaltes.
Até lá!
Fontes:
- https://www.scientificamerican.com/article/fact-fiction-glass-liquid/. Scientific American.
- digitalfire.com. Digital Fire.
- Bezerra Brandão, Bráulio. Curso de Engenharia Mecânica. http://www.ebah.com.br/
- Donald Sadoway, 3.091SC Introduction to Solid State Chemistry, Fall 2010 (MIT Courseware). http://ocw.mit.edu (acessado em 7/8/2018). Licença Creative Commons Attribution-Noncommercial-Share Alike.
- How to Calculate the Unity Molecular Formula. Ceramics Material Workshop. http://www.youtube.com/watch?v=HyLjAg1_8_4 (acessado em 8/8/2018). Youtube.






Muito bom, obrigada
Muito obrigado pela leitura!
Grato pelo texto Gustavo!!
Obrigado Paulo pela leitura!
Estava procurando uma explicação sobre fórmula de Seger e não encontrei nada como seu post!!! Sensacional sua explicação, e com exemplos! Muito obrigada
Obrigado Elaine pela leitura.
Maravilhosa sua explicação sobre os esmaltes,vou guardar como uma pérola…gratidão
Muito obrigado pela leitura!