Dando continuidade ao estudo, posto hoje sobre a teoria dos esmaltes com ênfase nos elementos químicos. É um texto técnico e requer conhecimento básico de química. Mas vou começar explicando tudo desde o início para que o conhecimento fique bem claro. Se sentirem enfadonho, podem pular os parágrafos que tem texto mais específico para o ceramista do meio para o final do post. Se alguém tiver dúvida, é só fazer pergunta no campo de comentários no final deste post.
Os Elementos Químicos
O big-bang, que marcou o início de nosso universo, criou toda a matéria. Porém, essa matéria se transforma dentro das fornalhas atômicas, no interior das estrelas. Elementos químicos com seus pesos atômicos baixos, como o hidrogênio, são fundidos em elementos como o hélio em estrelas do tamanho do nosso sol. Mas, elementos mais pesados como chumbo e urânio são criados em explosões de estrelas supermassivas quando tornam-se supernovas. Os resquícios destas explosões formam as poeiras cósmicas, nebulosas, que eventualmente se aglutinam formando novas estrelas e planetas. Como dizia o cientista Carl Sagan: “Nós somos todos feitos de poeiras de estrelas”.
Hoje em dia, sabemos que existem mais de 90 elementos químicos que ocorrem naturalmente. Nós, ceramistas, estamos mais interessados nos elementos que estão na crosta terrestre pois são eles que compõem as argilas e os esmaltes. Os mais abundantes são o oxigênio (sigla O), silício (Si) e alumínio (Al). O oxigênio em sua forma molecular (O2 e O3) é um gás mas na crosta terrestre ele é abundante na composição dos minerais pela sua incrível capacidade de se ligar a quase qualquer outro elemento formando óxidos (mais tarde trato disso).
Além desses três elementos, temos também o ferro (Fe), cálcio (Ca), sódio (Na), potássio (K) e magnésio (Mg) em abundância na crosta terrestre.

A Estrutura dos Átomos
O modelo atômico atual é muito complexo mas para nós vale dizer que o próton (carga positiva) e o nêutron (neutro) estão no centro do átomo (núcleo) e que o elétron (carga negativa) orbita ao redor desse centro. Grosseiramente falando, assemelha-se com o modelo planetário, com os planetas girando ao redor do sol.
Entretanto, o local exato da órbita do elétron é, pelo princípio da incerteza de Heisenberg, impossível de determinar. Na verdade, os modelos das órbitas eletrônicas (chamados de orbitais na mecânica quântica) são um palpite de que teremos mais chance de acharmos os elétrons em uma dada região.
Os elétrons se agrupam em orbitais que possuem capacidade de abrigar um número limitado de elétrons. Depois que um orbital é completo, o elétrons se acomodam em um novo orbital. Dependendo de seu formato, eles podem ser s, p d, e f. Depois que todos os elétrons preenchem todos os tipos de orbitais possíveis para a sua camada, o ciclo de preenchimento se repete. Chamamos este ciclo de período.
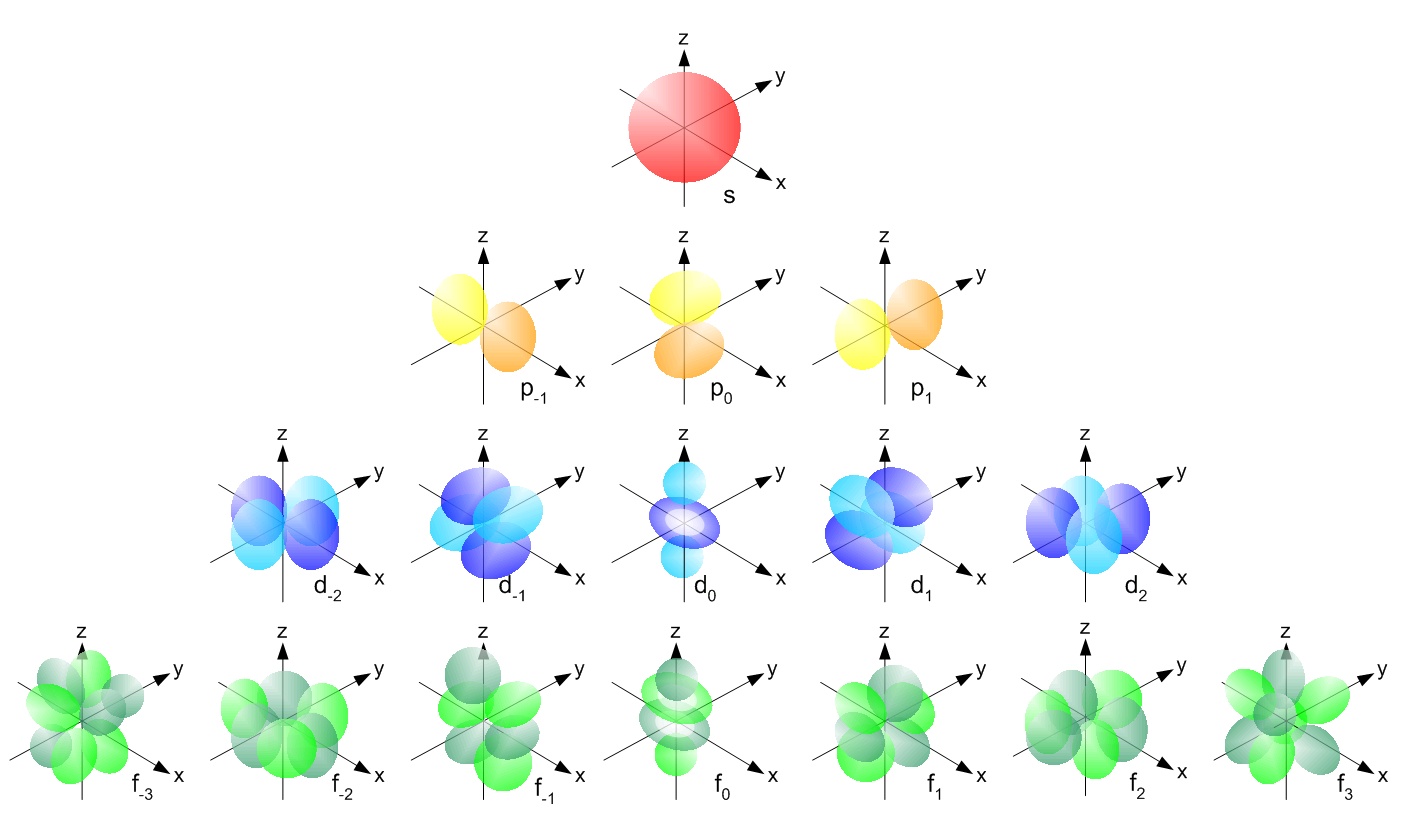
A quantidade de prótons que um átomo possui é o que define como elemento. O hidrogênio tem um próton, o hélio, dois, o lítio, três e assim por diante. Um átomo estável é aquele que tem o mesmo número de prótons e elétrons.
Costumamos agrupar os átomos pelo número de elétrons que possuem na última camada mais energética. Isso porque observou-se eles se comportam quimicamente de maneira semelhante. A quantidade de elétrons que um átomo precisa para completar sua última camada se chama de valência.
Os átomos, segundo a regra do octeto, sempre têm a tendência em completar sua última camada com oito elétrons. Para satisfazer essa regra, átomos podem compartilhar, doar ou receber elétrons dependendo da quantidade de elétrons que precisam ganhar (ou perder) para ficarem estáveis. Dessa relação entre os átomos, surgem as moléculas. Os gases nobres não reagem com nenhum outro elemento e são naturalmente estáveis, pois têm todos os 8 elétrons na sua última camada.
Exemplo:
O cloro tem 7 elétrons de valência e o sódio tem somente 1. Então o sódio perde 1 elétron e o cloro fica com 8 e ambos ficam estáveis nessa conformação. Esse é o sal de cozinha, ou NaCl, e sua formação obedece à regra do octeto.
Isso também explica porque o oxigênio é tão reativo, formando moléculas com praticamente todos os elementos usados pelos ceramistas nos esmaltes (ele é ávido por elétrons).
A Tabela Periódica dos Ceramistas
A tabela periódica é dividida da seguintes maneira: nas coluna estão os grupos. Como escrevi antes, representam o número de elétrons na última camada de cada elemento. Já as linhas representam o período ou o número de camadas, originando assim o seu nome desta tabela.
Tabela periódica com os elementos mais usados pelos ceramistas:

Elementos e seu uso nos esmaltes
Agora que aprendemos a base, vamos aplicar esse conhecimento para o campo da química dos esmaltes.
Grupo dos Metais Alcalinos e Alcalino Terrosos
Os fundentes, usados na cerâmica para ajudar no derretimento dos esmaltes (veja parte 1 deste post), estão localizados em sua maioria nos grupos dos metais alcalinos e alcalinos terrosos (parte esquerda da tabela).
Os metais alcalinos são muito reativos em sua forma pura e seus óxidos são poderosos fundentes. Eles também se combinam em moléculas com o carbono e oxigênio, chamados carbonatos, que são mais solúveis. O lítio (Li) é o fundente mais poderoso e por ter um peso atômico baixo, é necessário pouco dele para fundir completamente um esmalte. Seu ponto de fusão é alto em relação aos seus companheiros mas quando se funde, derrete-se completamente. Este elemento também tem o menor coeficiente de expansão de todo o grupo e por isso é usado em peças à prova de choque e fogo.
Os óxidos de potássio (K) e sódio (Na) são muito usados como fundentes principais em todas as temperaturas, são muito reativos e com alto coeficiente de expansão térmica (explico melhor sobre isso no quarto post). O óxido de sódio é usado para esmaltes de baixa temperatura, é solúvel em água e por isso é introduzido como feldspato ou frita. Ele é mais fundente que o potássio mas começa a volatilizar a partir de 1.200ºC, podendo criar bolhas no esmalte.
O óxido de potássio tem uma ação um pouco diferente e seu coeficiente de dilatação é mais baixo. Embora seja menos reativo, começa a agir a partir de 750º C e sua ação é uniforme em todas as temperaturas pois não volatiliza. É mais viscoso e dá mais resistência à peça mas não pode ser usado sem um fundente auxiliar porque o esmalte pode ficar quebradiço.
Os metais alcalinos terrosos são usados como fundentes secundários. Eles têm pontos de fusão muito mais altos mas quando usados em conjunto com outros elementos, o ponto de fusão total da mistura abaixa (mistura eutética, explico melhor isso no próximo post).
O cálcio (Ca) é um dos principais fundentes em média e alta temperaturas. Abaixo de 1.100º C não é um fundente reativo, mas sua ação dá dureza ao esmalte, resistência aos ácidos e envolve o óxido de chumbo, diminuindo sua solubilidade. Estabiliza a interação sódio/sílica, melhorando a resistência dos esmaltes e diminuindo a gretagem (ou craquelamento). Sua ação como fundente começa acima de 1.100º C, quando se torna um fundente ativo. Pela sua ação estável durante toda a queima, é importante em praticamente todo o esmalte.
O magnésio (Mg) é usado para fazer esmaltes acetinados e tem um baixo coeficiente de expansão. O bário (Ba) pode ser usado como fundente para temperaturas acima de 1.175º C para fazer esmaltes foscos. Porém a molécula fonte desse elemento, o carbonato de bário é tóxica se ingerido (ele já foi usado como veneno para matar ratos no passado). O estrôncio (Sr) pode ser usado como substituto por ser um fundente não tóxico e tem propriedades intermediárias entre o o cálcio e o bário. Tanto o estrôncio como o bário podem ser usados como fundentes de baixa-queima, se forem transformados em fritas.

O bário e o estrôncio mantêm as cores mais vivas que o magnésio e cálcio, que costumam descolorar o esmalte.
Metais de Transição
Os metais de transição, por terem orbitais do tipo d incompletos podem ter vários estados de oxidação, dependendo das condições do ambiente. Também por conta disso, possuem coloração mercante, característica essa usada pelos ceramistas que os empregam principalmente como pigmentos, dando cores aos esmaltes. Os mais usados como pigmentos são aqueles de menor peso atômico e incluem o titânio (Ti), vanádio (V), cromo (Cr), Manganês (Mn), Ferro (Fe), cobalto (Co), níquel (Ni) e cobre (Cu). Boa parte deles são anfotéricos (podem reagir como ácido ou base). O cobalto já foi um elemento muito valorizado por ser o ingrediente principal usado como baixo-esmalte nas famosas porcelanas chinesas brancas e azuis.

O manganês e o ferro têm várias valências, por exemplo o óxido vermelho (férrico) de ferro, Fe2O3, é ácido e refratário mas o óxido preto (ferroso) de ferro é fundente e alcalino.
Dependendo do tipo de queima, o interior do forno pode ter uma quantidade maior ou menor de oxigênio. Em ambientes com quantidade suficiente de oxigênio, dizemos que a queima é por oxidação. Caso contrário, quando há escassez de oxigênio na câmara, há a redução. O óxido de cobre pode conferir de modo dramático cores diferentes, sendo verde na oxidação e o vermelho na redução. O mesmo ocorre para o ferro, podendo ser amarelado em oxidação e verde ou azul em redução.

Apesar de estar no mesmo grupo, o zinco (Zn) não é tecnicamente de transição pois seu orbital d está totalmente cheio de elétrons. Ele não é usado como pigmentador mas como fundente em temperaturas médias. Na próxima fileira dos elementos, está o zircônio (Zr), usado para opacificar os esmaltes e o cádmio (Cd), usados em pigmentos de esmaltes amarelos e vermelhos. O molibdênio (Mb) e o tungstênio (W) são usados em esmaltes cristalinos iridescentes.
Ouro (Au), prata (Ag) e platina (Pt) são usados por ceramistas em pinturas em cerâmicas.
Lantanídeos (terra rara) e Actinídeos
O elemento cério (Ce), praseodímio (Pr), neodímio (Nd) e érbio (Er) são pouco usados na cerâmica e quando são têm a função de darem cor aos esmaltes. O praseodímio é usado com o silicato de zircônio para dar a cor amarela. Seu óxido se funde à 932º C e é muito tóxico.

Os outros lantanídeos podem das cores fluorescentes mas só quando iluminados por luz ultravioleta.
Na série dos actinídeos, temos o urânio (U), que foi usado no início do séc. XX como pigmentador de esmaltes para dar a cor amarelo-clara ou laranja mas foi abandonado por sua característica radioativa.
Outros Metais
O grupo dos outros metais (ou grupo de metais de pós-transição), tem a aparência brilhante metálica dos metais de transição mas são metais fracos, sendo mais maleáveis.
O alumínio é muito importante para os ceramistas. É um dos elementos mais abundantes da crosta terrestre, componente das argilas e usado como estabilizador, tornando o esmalte mais viscoso. Presente como alumina (óxido de alumínio), que é anfotérico. Possui uma temperatura de fusão bem alta, 2.050º C.
O estanho (Sn) é usado principalmente como opacificador e foi muito usado como fundo branco das cerâmicas majólicas.

O óxido de chumbo (PbO) já foi muito usado como fundente de baixas temperaturas, por ter ponto de fusão baixo. Hoje em dia, por sua toxicidade, vem sendo substituído por fritas à base de outros elementos (bário, lítio, etc.).
Não metais
No grupo dos não metais está o Boro (B), que é tanto fundente como formador de vidro. O silício (Si) é um elemento importantíssimo para os esmaltes pois ele é o principal formador de vidro. A sílica, que é seu óxido, é a base de quase todos os minerais. Como escrito na parte 1 deste post, seu ponto de fusão é alto mas ao lado de fundentes, o ponto de fusão da mistura abaixa, formando o que chamamos na química de mistura eutética (explico no próximo post sobre isso). A sílica é um óxido ácido, que reage com metais fundentes alcalinos.
O carbono (C) é o coadjuvante em muitas moléculas usadas pelos ceramistas. E seu formato carbonato (óxido de carbono), ele se combina com diversos elementos alcalinos e metais de transição. Ao ser levado ao forno, ele se volatiliza em gás carbônico (CO2) liberando gases na formação do esmalte.
O fósforo (P) é usado como fundente e opacificador em cerâmicas de alta queima. Também nesse grupo está o oxigênio (O), que é muito reativo e presente na maioria dos elementos usados pelos esmaltes tanto na forma de óxidos ou carbonatos.
O selênio (Se) é usado como pigmento laranja e vermelho nos esmaltes.
Semana que vem, vou escrever mais sobre as características químicas dos elementos dos esmaltes, as reações entre eles durante a queima e a fórmula molecular unificada.
Até lá!
Fontes:
- Bloomfield, Lisa. Chemistry for Potters. Ceramics Monthly, Fev. 2016.
- Fernandes, Tácito. Teoria de prática de esmaltes. https://www.facebook.com/notes/t%C3%A1cito-fernandes/teoria-de-pr%C3%A1tica-de-esmaltes/2247493835871/
- Britt, John.The Complete Guide to Mid-Range Glazes. Ed. Lark, NY.
- Hamer, Frank e Janet. The Potter’s Dictionary: of Materials and Techniques. Sexta edição. Ed. Bloomsbury.






Excelente texto. Fácil compreensão… Pena que algumas figuras não estão abrindo. A tabela periódica do ceramista, por exemplo. Fiquei na saudade! Mas obrigada pelas informações. Muito úteis. Parabéns.
Oi Lili, obrigado pela leitura! Quanto às imagens, eu conferi o post, abrindo no celular, tablet e desktop e em diversos browsers e todas as imagens abriram. Verifique a configuração do seu computador ou espere um pouco para a imagem carregar. Dependendo da conexão pode demorar. Espero que isso resolva!
Obrigada, Gustavo,
ótima e simples sua explicação sobre queima por oxidação e redução. Não encontrava isso em lugar nenhum. Valeu!
Muito obrigado pela leitura!
Ao começar a entender para que servem e como funcionan os elementos, passei a simpatizar com a química. Valeu Gustavo.
Obrigado Eudes pela leitura!
Muito esclarecedor e de fácil compreensão, Gustavo. Obrigada, me ajudou bastante
Muito obrigado Bel pela leitura!
Nossa!!!!
Prof. Nao li tudo ainda mas, desde já quero externar minga emoção ao ler a introdução.
Gratidão ao universo pela oportunidade.
Realmente um material maravilhoso! É um prazer ler e aprender. Parabéns!!
Obrigado Celia pela leitura!
Texto muito claro sobre os elementos que compõem os esmaltes. Estou indo bem devagar e aprendendo aos poucos sobre os esmaltes cerâmicos. Seu artigo é ótimo e vou continuar a ler e tirar minhas dúvidas!!!! São muitas!!!
Obrigado Valéria pela leitura!
Estou lendo seu post no futuro! Estamos em 2024 e estou aprendendo muito sobre esmaltes com voce. obrigada Gustavo do passado que compartilhou tantas informações conosco.
O Gustavo do presente te agradece!